連載
一覧細胞を科学する;棘皮動物ヒトデ胚の細胞研究は何を生み出すか【第2回】

金子 洋之(かねこ ひろゆき) 慶應義塾大学名誉教授
(2)ビピンナリア幼生期の機能システム
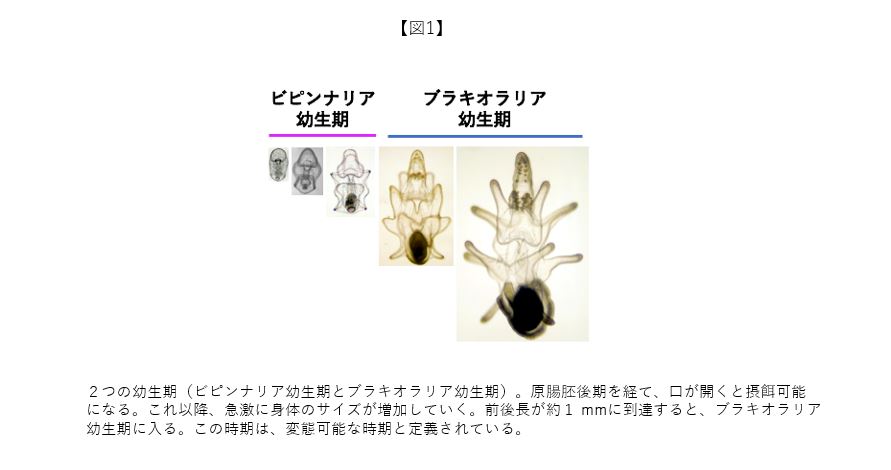
動物の胚は、原腸と口陥域が繋がると、摂餌を行う幼生期に移行する。多くの動物は幼生期に変態するが、その能力を獲得する必要がある。図1はヒトデの個体発生における幼生の変態能獲得前と後の時期を示しており、それぞれビピンナリア幼生期とブラキオラリア幼生期と呼ばれる。珪藻を餌に20℃の飼育条件下で、ビピンナリア幼生がブラキオラリア幼生期に達する迄には約1週間を要する。ビピンナリア幼生期には、変態に必要な腕、水孔葉や成体骨片も形成され始めると同時に、身体の著しいサイズ増加により成長が進行する。発生生理学の観点から、変態能を獲得する迄の過程において、ビピンナリア幼生の成長を保証する細胞機能の実体解明は大変興味深い。
前回、間充織細胞(Mesenchyme Cells: MCs)を題材として、ヒトデの胚期の細胞機能研究に言及した。MCsは細胞外マトリックスを介して胚体に物理的力を供与するだけでなく、上皮細胞(Epithelial Cells: ECs)の増殖も誘起していた。これらの機能が、幼生期における身体のフォルム形成やサイズ増加にも関与していることは十分に考えられる。これに加えて、幼生の時期に、第2回の前半では、(1)ビピンナリア幼生においてはMCsが生体防御システムの中心機能を担うこと、MCsは新たな機能を獲得するのだろうか。後半では(2)MCsが数多く分布する領域(繊毛帯)を中心に、神経細胞(Neuronal Cells: NCs)が大挙出現し始め、神経システムの中枢を形成することを言及する。
【生体防御システム】
19世紀末、ロシアの細菌学者メチニコフは細胞には貪食機能があることを発見した(この発見によりメチニコフは細胞性免疫学の祖と呼ばれている)。貪食機能の発見に至った実験結果は、ヒトデ幼生に刺したバラの棘をMCsが多核状態で覆っているスケッチとして残されている。ヒトデ胚のMCs屋としては、約100年前のメチニコフを追試しないわけにはいかず、ビピンナリア幼生の胞胚腔に種々の異物を顕微注射してみた。現代の顕微鏡解析技術を用いて、(1)MCsは小さなサイズのビーズやバクテリアなどを活発に貪食する(図2A)、(2)自身よりも大きな異物に対しては、MCsは複数で包囲する(図2B)特性を明らかにできた。このとき、MCsは互いに融合して多核体になることも電子顕微鏡で観察できている。以上、MCsは身体の内部環境に何もなかったごとく侵入した異物を隠微している状態と解釈できる。これは生体防御行動の本質である。
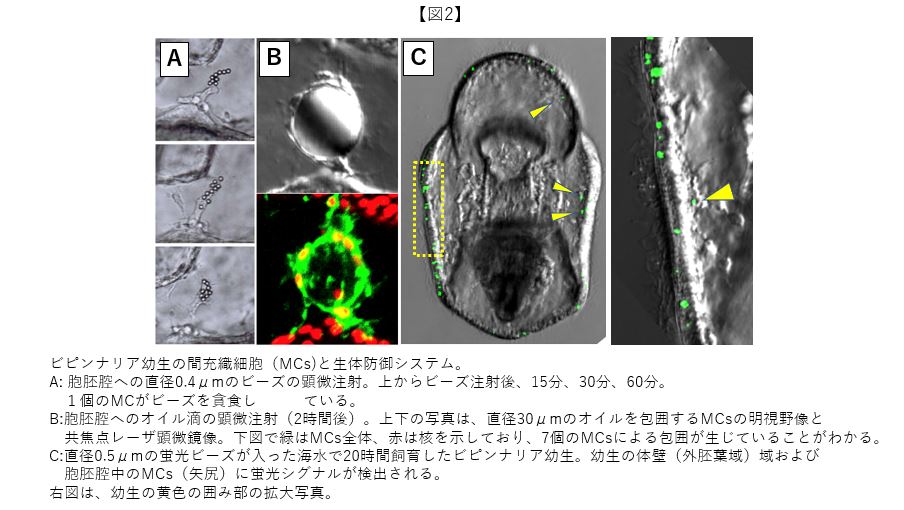
上記の(2)の結果は、前回紹介した培養皿に降り立つ際のMCs同士の自発的な融合と密接な関連がある。すなわち、MCsは培養皿を大きな異物として認識しており、隙間なく覆うために他のMCsと融合することにより水も漏らさぬ体勢(=包囲下状態)に至っていたとの解釈が成立する。また、バクテリアなどの小さな異物は、ビピンナリア幼生の体壁を通して胞胚腔に侵入し、MCsはそれらを貪食することも分かった(図2C)。この事実は、自然界でもビピンナリア幼生の生体防御システムが実際に稼働していることを示唆している。なお、胚期のMCsは胞胚体腔に顕微注射された異物にシャープな反応を示さないことから、貪食機能はビピンナリア幼生期に付加されたMCsの機能特性と考えられる。
これ迄、ビピンナリア幼生の生体防御システムに注目して、MCsが異物に対して示す行動に関する分子群の研究を進めている。その成果として、貪食作用を促進するオプソニン性の分子、異物へ向かう際の移動だけを制御する調節分子、異物攻撃に関わる数を適正に調節する分子などを同定できている。一方、ヒトデとウニの精子を混合して顕微注射した実験から、MCsには種を特異的に認識して防御行動を示すことも分かっており、異物認識に関与する分子の特定が今後の大きな研究テーマとなる。これらを通して、系統進化的な視点からも免疫システムを理解することに繋がっていくと期待される。
【神経システム】
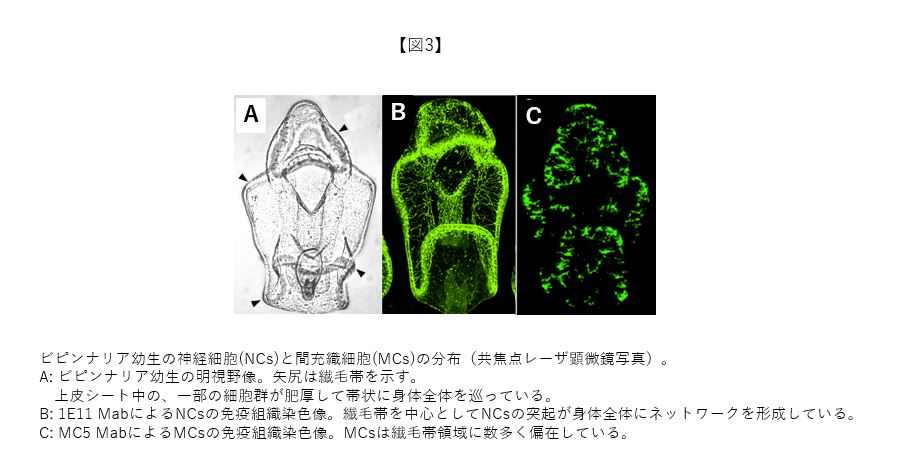
ビピンナリア幼生期の神経システムの解明では、NCsに特異的なモノクローナル抗体 (Monoclonal antibody: Mab) を作成することから研究をスタートさせた。MCsの場合と異なり、感作抗原をヒトデ成体の神経束にすることで、一発で目的のMabを2種類取得できた(1E11 Mabと1F9 Mabと名付けた)。1E11 Mabの抗原は、シナプトタグミンと呼ばれるシナプス機能に関する分子であった(1F9 MabはSTART領域を持った分子だが機能は不明)。1E11Mabは、ヒトデ幼生のみならず、ウニ、ギボシムシ、ホヤなどの多くの海産無脊椎動物の幼生神経を免疫組織化学的に広範に染色できるMabでもあった。両Mabを用いて行った免疫組織学的研究から、最もインパクトがある成果として、ヒトデ幼生の上皮シートに膨大な数のNCsが存在しており、繊毛帯を中心に神経回路のネットワークが発達している事実を公表できた(図3A, B)。また、繊毛帯付近の胞胚腔に偏在するMCsの分布パターンから(図3C)、神経システムと免疫システムにおける何らかの相互作用も予想される。
ビピンナリア幼生の遊泳行動に着目して、温度感受性チャネル(Transient receptor potential: TRP)の一種、TRPA1に関する共同研究を行い、海産無脊椎動物のプランクトン幼生におけるTRP機能を初めて証明した論文を上梓できた。その論文では、解析用チャンバーを製作することから始め、TRPA1遺伝子の単離、分子系統樹作成、時空間的な発現の記述、カエル卵でのTRPA1発現系における電気生理学的性質の解析、遺伝子発現のノックダウンによる遊泳解等、あの手この手で研究を進めた。これらの結果から、ビピンナリア幼生は環境温度に対する正の走性があることを明らかにできた。この温度走性は高温側へ無制限に向かうことに特長があり、扁形動物プラナリアの低温への走性、昆虫のショウジョウバエが有する23℃付近を目指す走性と異なっていた。論文を執筆している段階で最も苦労したのは、全長10cm足らずのチャンバーに形成した温度勾配での解析結果を自然界での出来事として捉えられるのかというレフェリーからの査読コメントであった。多くの文献を漁りに漁っても答えは見つからず、考えついたのは自然界に存在している異なった温度の海水塊の間には温度勾配が形成されるだろうというアイデアであった。これで許してもらえた。実際、温度が高い海水塊は浅瀬側にあり、ヒトデのビピンナリア幼生は浅い海域に移動して変態するのではないかと考えている。
ヒトデのビピンナリア幼生の機能システム研究として、生体防御や神経システムの研究以外にも、核型トランスグルタミナーゼのエピジェネテック制御による成長やクラスリンという飲作用分子が消化システムを制御している可能性についての研究成果も蓄積できてきている。私たちが研究に用いているヒトデはイトマキヒトデという種であり、その成体は、北はウラジオストックから、南は奄美まで広く生息している。しかしながら、このように生態学的に成功している動物種であるにも関わらず、ヒトデ幼生の細胞機能や機能システムと自然環境の関わりについては殆ど何も分かっていない。最近、海洋といったダイナミックに変化し続ける広大な自然環境に対して、小さな粒子状の生物であるに過ぎない海産無脊椎動物のプランクトン幼生は、何らなすすべも無く揺蕩っているわけではないと考えられ始めている。現在、成体と大きく生活様式が異なっているプランクトン幼生を対象とした発生生理学は未だ十分に統合されていない。マリンバイオロジーの新たな研究分野として、海洋と細胞機能を連関させた研究が将来的に広がっていく余地は十分にあると予測する。

