連載
一覧細胞を科学する;棘皮動物ヒトデ胚の細胞研究は何を生み出すか【第3回】

金子 洋之(かねこ ひろゆき) 慶應義塾大学名誉教授
(3)ヒトデ胚の再構築
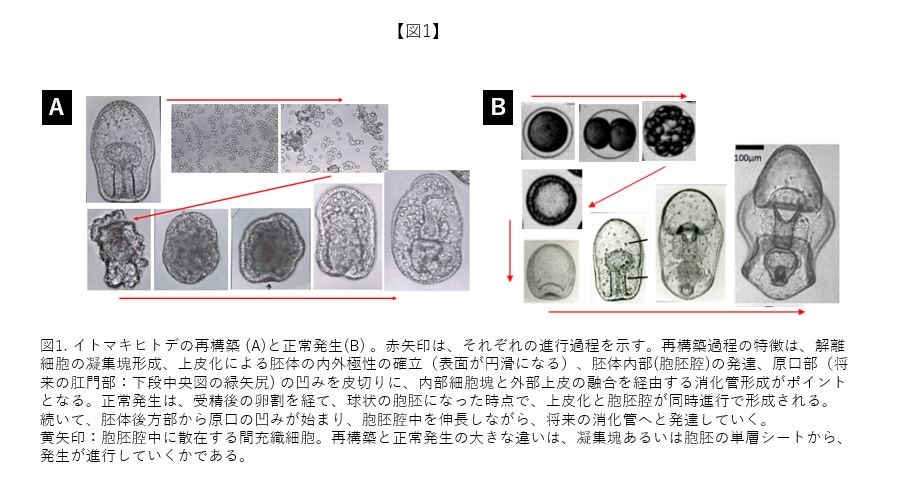
再生とは、身体の部分が切除された後、もとのように部分が形成されてくる生命現象である。多くの動物は再性能を有しており、トカゲの尾、イモリのレンズ、ヒトデの腕、ヒトの肝臓など枚挙に遑がない。今回は、ヒトデ胚を用いた細胞機能の研究において、再生と似て非なる、そしてより強烈な印象を与えるヒトデ胚の再構築について言及する。人に説明する際には、身体をいったん細胞にまでバラバラにして、再び身体を作らせるというキャッチーな表現が伝わり易い。図1は、私が研究に用いているイトマキヒトデの再構築過程と正常発生過程を示している。再構築では、原腸胚を個々の細胞にまで解離後、凝集塊を形成させると、発生が進行し、帳尻を合わせるように正常な形態の幼生が構築されてくる。この再構築現象には、細胞機能の解析系として2つの価値が認められる。一つ目は、正常発生過程において存在が気付き難い形態形成メカニズム、二つ目は胚細胞が有する領域運命の可塑性を露わにすることである。なお、再構築は自然界では生じず、人為的な実験系でのみ再現可能となる。
前者の代表例として、複数の細胞種からなる器官において、それぞれの細胞が互いを識別し、同種細胞どうしが接着する生命現象である細胞選別が挙げられる。細胞選別研究の歴史は古く、1912年のカイメンの凝集実験に端を発する。紫色と橙色の2種のカイメンを個々の細胞にまで解離して混合したところ、それぞれの色の細胞どうしで接着が生じ、紫色と橙色の凝集塊が形成されることが観察されていた。その後、カイメンのような原始的な動物だけでなく、カエルやニワトリ胚の細胞を材料に用いた実験においても細胞選別の報告がなされ、互いを識別する能力が動物細胞には普遍的に備わっていることが分かってきた。
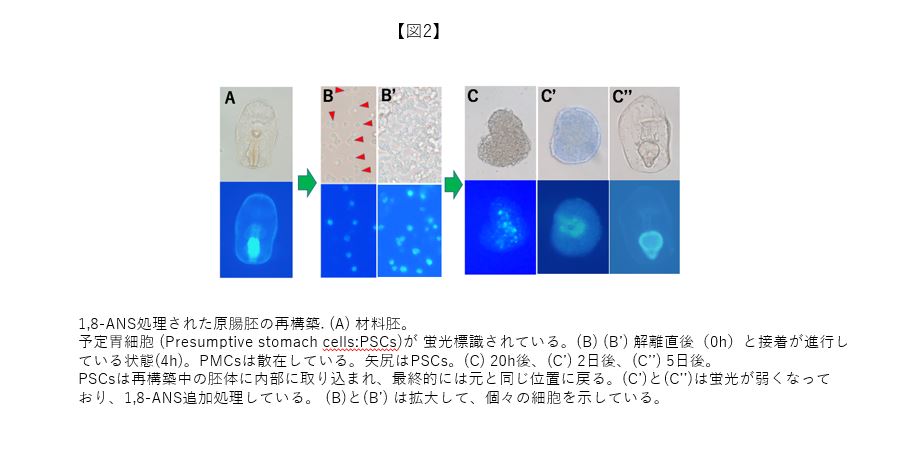
細胞選別現象の生理学的意義は、生体の器官内において同種細胞群が近傍に位置し、組織を成立させるためのメカニズムとも捉えられる。ヒトデ胚の再構築研究では、原腸胚後期に生じる予定胃細胞 (Presumptive Stomach cells: PSCs) の選別現象について解析した。選別の可否を示すためには、目的の細胞を生きた状態で標識しなければならない。PSCsは、紫外光で蛍光を発する1,8-ANSと呼ばれる物質で標識でき(図2A)、再構築過程での追跡観察も可能であった。観察の結果、解離された細胞集団の中に蛍光を持ったPSCsが混ざっている状態から(図2B、B’)、凝集塊中に混在し(図2C)、原腸形成を経て(図2C’)、開口後に完成する消化管の胃の中にPSCsが配置することが見出された(図2C’’)。本研究の価値は、動物の器官形成で直裁的に細胞選別が示された点にあり、NHKの「驚異の小宇宙人体」というTV番組でも紹介された。最近、初期原腸胚の再構築において、外胚葉と中内胚葉の細胞間でも選別が生じることを明らかにしている(この解析結果については、次回の“細胞の意思”において取り上げる)。
細胞選別現象以外に、再構築研究から明らかになった正常発生過程での形態形成メカニズムの存在についても書いておきたい。ヒトデの正常発生では、原腸先端部が予定食道域に沿って後方側に膨出することにより、体腔嚢が形成される(“腸体腔型”形成と呼ばれる)。再構築胚における体腔嚢形成を観察したところ、“腸体腔型”形成に限らず、胞胚腔に散在した体腔嚢細胞が食道側方に凝集することによっても生じていた(こちらの様式は“裂体腔型”形成と呼ばれる)。これらの結果から、体腔嚢が常に食道の側方域に形成されるのは、「原腸先端部が、前方に向かわずに、食道側方部に沿って後方に膨出させるための位置情報シグナルが食道から出されている」メカニズムがあることが予想される。
続いて、二つ目に挙げた胚の領域運命の変更に関する話に移る。再構築実験下におけるPSCsの選別は、細胞分化の結末を変えずに然るべき位置に配置するように、PSCsの領域運命を全うさせた。この様な状況は、胚体を構成する全ての細胞において生じているのだろうか?内胚葉と対比される外胚葉の口領域の細胞において、このテーマにチャレンジした。口に着目した理由は、再構築幼生には、複数の肛門が形成されることはあっても、口は必ず1つだけしか形成されない事実にある。外胚葉でも限定された器官を形成するためには、内胚葉のPSCsと同様に細胞選別が強力に作動すると思われる。そうは言っても、内胚葉に比べて、より広い面積の上皮シートである外胚葉中に予定口細胞だけが集まることができるだろうか?もし別の領域の細胞が口領域に配置するのなら、それらの細胞は領域運命を変えている可能性が浮かび上がる。
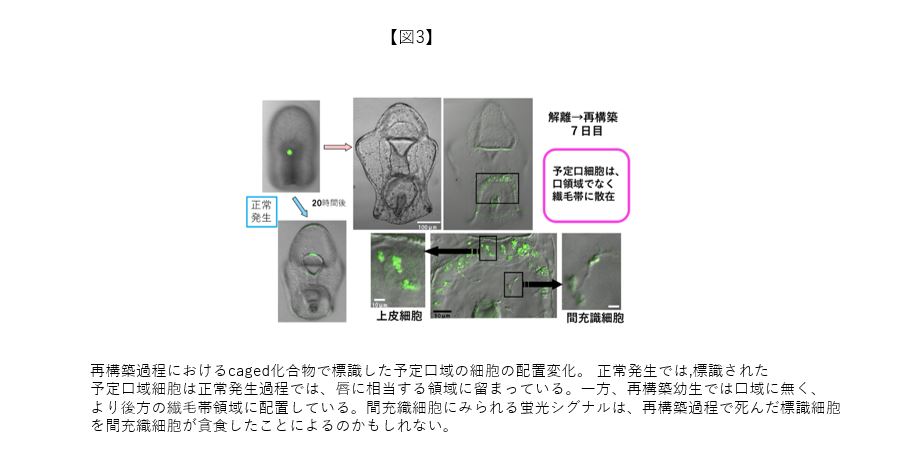
予定口領域だけを標識できる薬剤は見当たらなかった。そこで、予定口域だけを標識すべく、caged化合物を顕微注射した受精卵を発生させ、紫外光のスポット照射をとおして、任意の発生時期に、任意の領域を標識するシステムを作成した。並行して、旋回培養を利用した1個体からの再構築胚作製法も考案した(1個体からの再構築は構成細胞の比率が正常発生の個体と一致するという利点もある)。図3は予定口域を標識した後期原腸胚を示している。これを材料として得た再構築幼生において、標識細胞は口領域には存在せず、口・反口領域の境界となる外胚葉の繊毛帯領域に組み込まれていた(繊毛帯では多くの神経細胞が分化し、幼生の身体を覆う神経ネットワークの基点となっていく)。この実験結果から、再構築幼生で形成された口は、もともと予定されていた口領域の細胞でなく、外胚葉のどこか別領域からやってきたことになる。言い換えれば、再構築下の外胚葉では、少なくとも一部の細胞は自身の領域運命を変更させていると捉えられる。
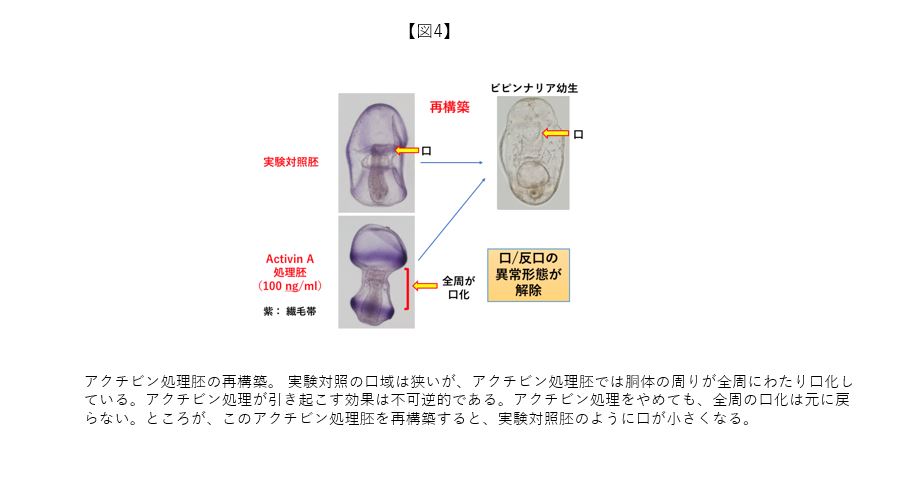
その後、再構築過程で領域運命が可塑的に変更される現象は、次の実験でも確認できた(図4)。アクチビンという生理活性物質で正常発生過程のヒトデ胚を処理すると、口領域が著しく拡大することを見出した(処理胚は、ダンベルのような形をした胴体部が広範に口域化した幼生になる)。アクチビン処理は不可逆的であり、アクチビンを取り除いても、決して正常な状態の狭い範囲に限定された口域化には戻らず、ダンベル状態のままである。続いて、アクチビン処理胚を再構築してみた。驚くべきことに、再構築されてきた幼生はアクチビン処理の呪縛から解き放たれるように、正常な形態の幼生と同様な口領域を持つ再構築幼生となった。この事実は、再構築過程で細胞の領域運命が口側から反口側に変更されたことを示している。別の言い方をすれば、正常発生での不可逆的な領域変更が再構築することにより解除できることになる。現在、再構築過程で発現する遺伝子群を網羅的に解析している。その中で、再生医療の主役として注目されているiPS細胞の作成過程で細胞運命をリプログラムさせる一部の遺伝子が、ヒトデ胚再構築系でも発現していることも分かってきた。再生医療研究において、3次元構築された器官形成が大きな目標の一つに掲げられている。ヒトデ胚の再構築実験系から有益な知見を再生医療研究に発信できる可能性が直感される。