連載
一覧細胞を科学する;棘皮動物ヒトデ胚の細胞研究は何を生み出すか【第1回】

金子 洋之(かねこ ひろゆき) 慶應義塾大学名誉教授
(1)ヒトデの胚発生における間充織細胞の役割
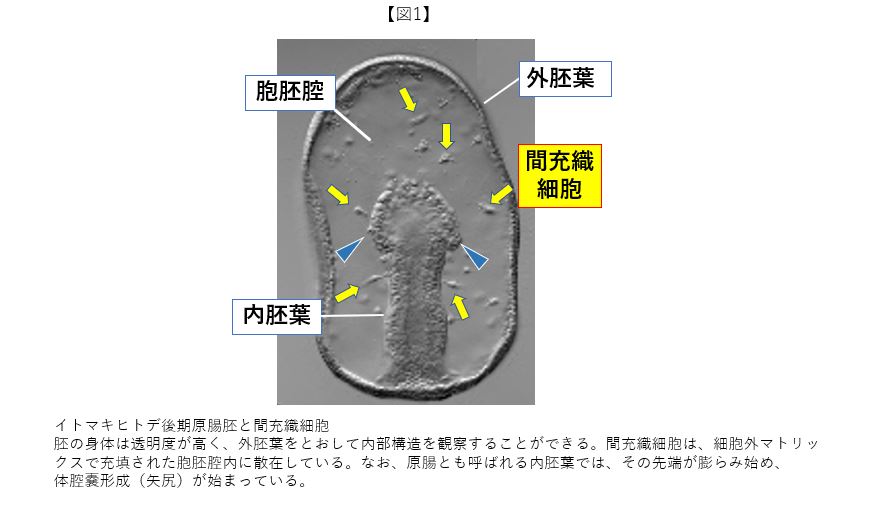
大阪市立大学に助手の職を得て、研究材料がイモリ胚からヒトデ胚に変わった。回想も混じえて書いていく。ヒトデ胚の身体の構造は非常にシンプルである(前回の幼生図も参照)。図1に示す後期原腸胚では、上皮細胞(Epithelial Cells: ECs)が隙間なく接着し合った単層の上皮シートからなる外胚葉が外部環境と境界をなし、胚体の後部から消化管になる内胚葉が胚体内部に陥入しているだけである。透明性が高い両胚葉間に挟まれた胞胚腔には、1種類の間充織細胞(Mesenchyme Cells: MCs)だけが散在している。ECsとMCsの細胞数の比は、約100:1である。胚体が構築されていく過程において、どの様にECsとMCsは作用し合うのだろうか。この問題を解明するためには、それぞれの性質を知ることが第一歩となる。そこで、培養下で心筋細胞を解析してきた経験を生かして、ヒトデ胚を個々の細胞にまで解離後、培養基質となるシャーレ上に播いてみた。胚体の大多数をなすECsは互いに凝集してシャーレ表面から離れていったが、MCsは残っていた(図2Cに相当)。ずっと観ていたら、MCsは自発的に融合するだけでなく、再び分離するといった行動を示した。心底驚いた。これが契機となり、イモリ胚の心筋細胞研究から離れ、海産無脊椎動物の細胞機能の研究が私のライフワークになった。
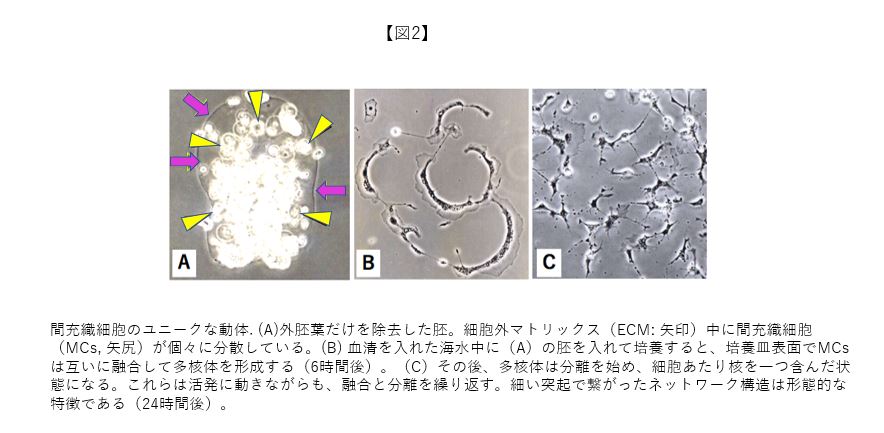
同じ棘皮動物ウニ胚の骨片形成を行う第1次MCsと比べ、より普遍的な結合組織性の間葉系細胞に着目しているだけでなく、自発的な融合・分離といった動的特性の新規発見とも相まって、私のヒトデ胚の細胞機能の最初の研究成果は案外スンナリと論文に採択された。論文には、外胚葉細胞だけを選択的に除外した状態の丸ごと胚(図2A)の培養で、(1)MCsは急激に融合して葉状仮足を発達させたアメーバ様の多核体としてシャーレ底表面に降り立ち(図2B)、活発に移動しながら、多核体から単一細胞へと分離し、最終的には互いに細胞突起で連結し合ったネットワーク構造を形成すること(図2C)、(2)このネットワーク構造も非常に動的で、単一細胞になったMCsは融合・分離を繰り返して核や細胞質を交換するなど非細胞的とも言える特性があることを記載した。以上、ヒトデ胚MCsは細胞質に1個の核を持つという常識に収まらず、非常にユニークな動的性質を持つことを明らかにした。
続いて、「培養下で観察したMCsの動的特性は、発生過程の何において重要なのか?」というテーマに歩を進めた。ヒトデ胚後期に生じる口形成において、予定口陥域にMCsは数多く集まってくる。胞胚腔で隔てられている内胚葉と外胚葉に対して、MCsは正確な口形成位置を伝達しているかもしれないとラボ内では大いに盛り上がっていた。証明戦略として、当時トレンドとなっていたモノクローナル抗体(特異的なエピトープだけと結合する単一種のB細胞が分泌する抗体)(Monoclonal antibody:Mab)の取得が突破口になるだろうと考えた。ヒトデ胚の全細胞をマウスに感作して、感作マウスの脾臓細胞と増殖性のミエローマ細胞をポリエチレングリコールで融合させ、目的のMabを分泌するハイブリドーマ細胞をスクリーニングしていった。先ずは、MCsだけを免疫組織化学的に特異的に染色できるMabを手に入れることが目的達成への第一歩となる。
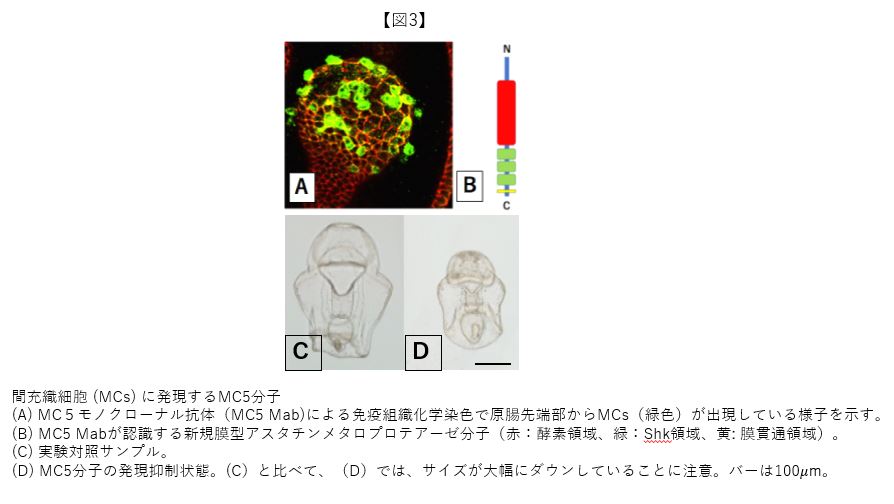
このアプローチは難航し、目的のMabを得るまでに8年間を有した。細胞以外の胚体成分である細胞外マトリックス(Extracellular Matrix: ECM)に対するMabばかりがやたらと取れてきて、たまに細胞を認識するMabであってもMCs特異的ではなかった。8年間は試行錯誤の連続で、感作抗原を純粋なMCs集団だけにすること、免疫抑制剤の使用、数打ちゃ当たる方式での体力勝負など手を替え品を替えてのチャレンジの連続であった。突破は、MCsだけを抗原とする際に汚濁混入していたECMを、トリプシン酵素で溶解除去したことが鍵となった。約25年前の7月、学生実習で京大の白浜臨海実験所に出張した折に、研究室の学生に頼んでおいたスクリーニングの解析結果を実験所近くの砂浜に立っていた公衆電話で尋ねた。8年もの不作続きでもあり、また駄目だろうなといった気分であったとは思うが、電話口には「取れてますよ!」とのニコニコした(?)ハイトーンな声があった(図3A)。カンカン照りの真夏日だったが、いっとき時間が止まり、砂浜の白さが眩しく、喧しかったセミの声も一瞬消えた記憶がある。
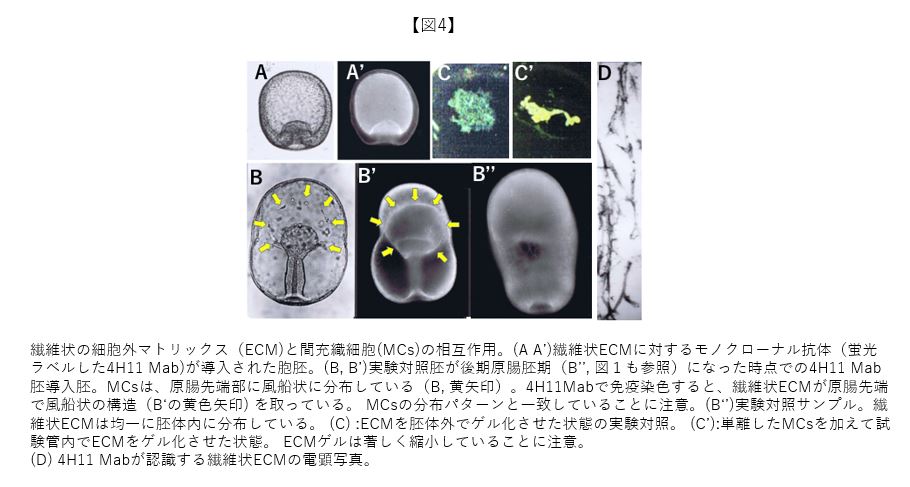
8年の間、難航していたMab作成の傍で、Mabを用いた機能証明に必要となる胞胚腔へのMab導入法の開発を行なった。邪魔者扱いしていたECMの繊維状成分(図4D)に対するMab(4H11 Mab)を試しに胞胚腔に導入したところ(図4A, A’)、MCsの機能について大変興味深い事実が見つかった。本来、繊維状ECMは解けたり再び編み上げられたりしながら、発生進行に伴って胞胚腔中に張り巡らされることが必要である(図4B’’)。抗体分子は抗原と結合する2本の腕を持っており、抗原を固定させる効果がある。胞胚腔内に導入された4H11Mabは繊維状ECMを胞胚期の胞胚腔の形に固定させ(図4A’)、原腸胚後期に達してもその形のまま原腸先端部で風船状構造として存在する(図4B’:黄色矢印)。この状況でMCsは必ず風船状構造と一致して分布する(図4B:黄色矢印)。以上の結果から、MCsが繊維状ECMに強い親和性を持つことが明らかなった。さらに発生を進行させると風船状構造は萎んでいったことから(写真は省略)、MCsが繊維状構造に対して物理的力を発生させている可能性も浮かび上がった。この仮説を調べるべく、試験管内で繊維状ECMをゲル化させる系を作成し、MCsを加えてみたところ、実験対照と異なって形成されてくるゲルが著しく縮小した(図C, C’)。MCsは繊維状ECMに物理的力を発揮して、胚体を胞胚腔側から絞り込んでいると考えている(最近、多様な細胞機能に物理的力が重要であることが分かってきている)。瓢箪から駒のように、MCsの機能について、知りたかったことの一部が明らかになった。
さて、MCsに特異的なMab (MC5 Mabと名付けた)を導入する実験はどうなったか? 期待とは裏腹に4H11Mabのような分かりやすい結果は得られなかった。しかしながら、苦節8年なので、潔く諦める気には到底なれず、MC5 Mabの抗原分子(MC5分子)の実体解明に向かうことになった。再び試行錯誤はあったが、MC5 Mabを用いたMCsのcDNAライブラリーのスクリーニングにより、MC5分子はザリガニの消化酵素とよく似たアスタチンと呼ばれるメタロプロテアーゼであることが判明した。腔腸動物ヒドラでも類似の遺伝子構造は報告されていたが、MC5遺伝子の新規性としては膜貫通型であることが示された(図3B)。MC5遺伝子はMCsにかなり大量に発現しているゆえ、何らかの重要な役割を持つことが予測された。そこで、モルフォリノオリゴ(MO)を用いた遺伝子機能のノックダウン解析を行ったところ、胚サイズの減少が見出された(図3C, D)。この実験結果から、MC5分子は胚体サイズの増加、言い換えればMCsはMC5分子を使ってECsの増殖誘起に関与していることが示唆された。この可能性は、MCsを胚の胞胚腔に直接注入して胚体内のMCs数を増やす実験において、胚体サイズが増加することからも支持される。
今回、独自に作成したMabを活用して、ヒトデの胚発生におけMCsの役割を探ってきた研究に言及した。MCsは繊維状ECMと密接に作用して胚体を絞り込んでいること、そして胚体を構成するもう一つの細胞性成分であるECsの増殖を誘導することを示した。なお、培養下で最初に見出したMCsの非細胞的な特性については、より発生が進んだ幼生期に、その生理学的意義の一端が明らかになる。次回に紹介する。

